Vova Krasen
0
3584
397
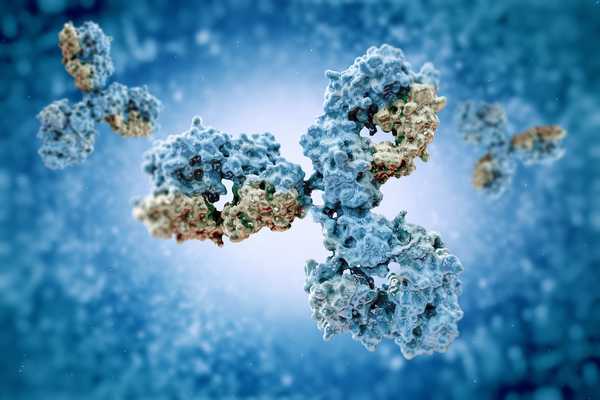
Gli anticorpi sono proteine specializzate a forma di Y che si legano come un lucchetto agli invasori estranei del corpo, siano essi virus, batteri, funghi o parassiti. Sono il battaglione di "ricerca" del sistema di ricerca e distruzione del sistema immunitario, incaricato di trovare un nemico e contrassegnarlo per la distruzione.
"Vengono rilasciati dalla cella e vanno a caccia", ha detto il dottor Warner Greene, direttore del Center for HIV Cure Research presso il Gladstone Institutes di San Francisco.
Quando gli anticorpi trovano il loro obiettivo, si legano ad esso, il che innesca una cascata di azioni che sconfiggono l'invasore. Gli anticorpi fanno parte del cosiddetto sistema immunitario "adattivo", il braccio del sistema immunitario che impara a riconoscere ed eliminare specifici agenti patogeni, ha detto Greene.
Relazionato: Diagramma del sistema immunitario umano (infografica)
Che aspetto hanno gli anticorpi?
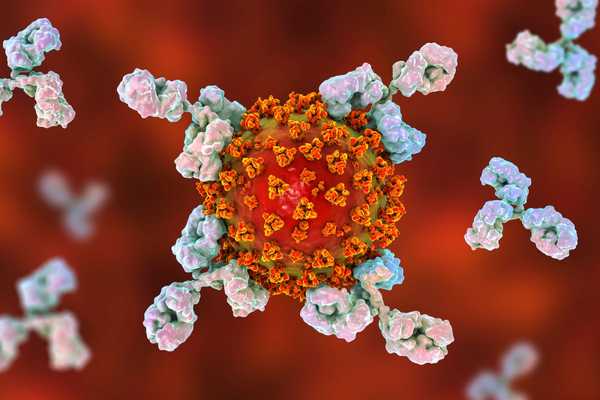
I due bracci nella parte superiore della forma a Y dell'anticorpo si legano a ciò che è noto come antigene. L'antigene può essere una molecola o un frammento molecolare, spesso una parte di un virus o di un batterio. (Ad esempio, il nuovo coronavirus SARS-CoV-2 ha "punte" uniche sul suo rivestimento esterno e alcuni anticorpi si legano e riconoscono queste proteine spike.)
La parte inferiore della Y, o gambo, si lega a molti altri composti del sistema immunitario che possono aiutare a uccidere l'antigene o mobilitare il sistema immunitario in altri modi. Un insieme di questi, ad esempio, innesca la cascata del complemento, ha detto Greene .
"Il complemento è in realtà il carnefice", che fa dei buchi nella cellula bersaglio, come la membrana di un virus, ha detto Greene.
Gli anticorpi, che sono anche chiamati immunoglobuline (Ig), hanno tutti la stessa forma di base a Y, ma ci sono cinque variazioni su questo tema - chiamate IgG, IgM, IgA, IgD e IgE, ha detto Jason Cyster, professore di microbiologia e immunologia presso l'Università della California, San Francisco.
Ogni variazione ha un aspetto leggermente diverso e svolge ruoli leggermente diversi nel sistema immunitario. Ad esempio, l'immunoglobulina G, o IgG, è solo una Y, mentre l'IgM assomiglia un po 'alla dea indù a 10 braccia Durga, con cinque Y impilate insieme e ogni polo può legare un antigene.
IgG e IgM sono gli anticorpi che circolano nel flusso sanguigno e vanno negli organi solidi, ha detto Cyster. L'IgA è "schizzato fuori dal corpo", nel muco o nelle secrezioni, ha detto Cyster. Secondo l'American Academy of Allergy, Asthma & Immunology, IgE è l'anticorpo che in genere innesca risposte allergiche, come polline o arachidi. Le IgD sono state storicamente enigmatiche, ma uno dei suoi ruoli è quello di aiutare ad attivare le cellule che producono gli anticorpi.
Relazionato: Febbre da fieno e allergie stagionali: sintomi, cause e trattamento
Dove si formano gli anticorpi?
Per capire gli anticorpi, devi prima conoscere i linfociti B, che sono un tipo di globuli bianchi che si forma nel midollo osseo. Ci sono circa un trilione di cellule B nel corpo e ognuna ha un anticorpo IgM unico che si trova sulla superficie delle cellule B e ciascuna si lega a un antigene, ha affermato Simon Goodman, responsabile del programma di scienza e tecnologia per The Antibody Society , un'organizzazione senza scopo di lucro che rappresenta coloro che sono coinvolti nella ricerca e nello sviluppo di anticorpi.
Questo incredibile livello di variazione consente al corpo di riconoscere quasi tutte le sostanze che potrebbero entrare. Ecco come si ottiene tale diversità: in ogni cellula B, i geni che codificano per il sito di legame dell'anticorpo vengono mescolati come carte da gioco in un mazzo.
"La quantità di riorganizzazione che può verificarsi è enorme", ha detto Cyster .
Relazionato: 11 fatti sorprendenti sul sistema immunitario
Queste cellule B quindi pattugliano il corpo, spesso indugiando più a lungo in aree come i linfonodi o le tonsille, ha detto Cyster. Il più delle volte, questi linfociti B non legano nulla. Ma se, per una probabilità su un milione, una cellula B si lega a qualche sostanza estranea ", ciò fa sì che la cellula B dica 'Ehi, dobbiamo attivarci'", ha detto Cyster.
La cellula B cresce di dimensioni e inizia a dividersi in quella che viene chiamata "espansione clonale", ha detto Cyster.
"È una copia identica del genitore, proprio come la madre", ha detto Cyster. Dopo una settimana circa, potrebbero esserci da centinaia di migliaia a un milione di queste copie.
Alla fine, queste cellule B espanse clonalmente si differenziano in plasmacellule, che sono fabbriche di anticorpi.
"Secernono 10.000 anticorpi per cellula al secondo. Possono farlo per settimane o anni se sei fortunato", ha detto Cyster.
Ma non tutti i linfociti B dividono la stessa quantità.
"Se consideri la cella B come un lucchetto e consideri che tutte queste cose diverse fluttuano come chiavi diverse, allora alcune chiavi si adatteranno meglio, altre peggio e altre no affatto ", ha detto Goodman. "E a seconda di quanto bene la chiave si inserisce nella serratura sulla superficie di una particolare cellula B, quella cellula verrà attivata per dividere di più". Quindi, i linfociti B più prolifici producono più plasmacellule e producono più di un tipo specifico di anticorpo.
Il corpo non produce solo un tipo di anticorpo; ne produce uno zoo disordinato e caotico. Ciascuno si aggancia a parti diverse di un invasore.
E gli anticorpi non fanno tutti la stessa cosa una volta che si sono legati a un bersaglio. Alcuni stronceranno l'infezione sul nascere neutralizzando direttamente una minaccia, impedendo a un agente patogeno di entrare in una cellula. Altri etichettano gli invasori, in modo che le cellule killer del sistema immunitario (che non sono anticorpi) possano rimuoverlo, ha detto Greene. Altri ancora possono avvolgere virus o batteri in un rivestimento appiccicoso. E altri anticorpi potrebbero dire a cellule immunitarie simili a Pac-Man chiamate macrofagi di divorare l'invasore. (Quella strategia a volte può ritorcersi contro i virus, che potrebbero cooptare questa risposta per invadere nuove cellule, ha aggiunto Cyster.)
Il primo tipo di anticorpo che si forma dopo essere stati esposti a un virus è l'IgM, che emerge entro 7-10 giorni dall'esposizione, ha detto Greene. Le IgM possono legarsi a un invasore, ma ogni "Y" in questa proteina a 10 braccia lo fa in modo abbastanza debole. Ma, proprio come cinque persone deboli che lavorano insieme possono affrontare un avversario grande e forte, le cinque Y (10 braccia) di IgM che lavorano insieme possono legarsi strettamente a un antigene, ha aggiunto..
A circa 10-14 giorni, il corpo inizia a produrre IgG, che è "il principale cavallo di battaglia" del sistema immunitario, ha detto Greene. Le IgG possono attraversare la placenta in una donna incinta, fornendo al neonato una protezione passiva contro le malattie fino a quando il proprio sistema immunitario non può aumentare, ha aggiunto Greene.
Normalmente, il sistema immunitario è straordinariamente bravo a riconoscere il nemico e ad ignorare o tollerare le nostre stesse cellule. A volte, tuttavia, questo processo va storto. È allora che entrano in gioco i linfociti T (un altro tipo di globuli bianchi). Il corpo utilizza questi linfociti T per il controllo incrociato degli obiettivi - solo se sia un linfocita B che un linfocita T riconoscono qualcosa come un invasore estraneo risposta essere attivata, Goodman ha detto. Il corpo dovrebbe rimuovere le cellule B che producono i cosiddetti autoanticorpi, che reagiscono alle cellule del corpo. Ma quando ciò non accade, il corpo può marcare le proprie cellule per la distruzione e quindi eliminarle senza sosta. Possono verificarsi malattie autoimmuni come il lupus, l'artrite reumatoide o il diabete di tipo 1, ha detto Goodman. Ci sono più di 100 malattie autoimmuni, secondo l'American Autoimmune Related Diseases Association.
Cosa sono gli anticorpi monoclonali?
Gli anticorpi sono diventati la base per alcuni dei farmaci più utili, così come alcune delle più potenti tecniche di laboratorio in biologia, ha detto Goodman. Una di queste superstar cliniche e terapeutiche è ciò che è noto come anticorpo monoclonale.
Per creare un anticorpo monoclonale, i ricercatori vaccinano un animale (o forse un essere umano) per stimolare la produzione di anticorpi contro una particolare sostanza. Il corpo produrrà gradualmente anticorpi sempre più efficaci contro quell'antigene. Queste cellule produttrici di anticorpi vengono quindi filtrate dai globuli bianchi e messe in un piatto per vedere quali cellule si legano meglio all'antigene, ha detto Goodman. La cellula che si lega meglio viene quindi isolata: è una fabbrica di produzione di anticorpi, appositamente affinata per produrre un anticorpo super selettivo.
Da lì, quella cellula viene fusa con una cellula cancerosa del sangue, producendo qualcosa chiamato ibridoma. Questo ibridoma, o monoclone, è un generatore inesauribile esattamente dello stesso anticorpo, ancora e ancora e ancora. (I ricercatori legano la cellula monoclonale a una cellula cancerosa perché il cancro continua a riprodursi.)
"Si limita a produrre, produrre e produrre, e non si fermerà mai, ed è un cancro, quindi è essenzialmente immortale", ha detto Goodman. Ciò che produce è un anticorpo monoclonale.
Relazionato: Il sangue del sopravvissuto all'Ebola potrebbe portare a un futuro vaccino
Tali linee cellulari hanno una gamma di usi incredibilmente diversificata. Ci sono milioni di anticorpi monoclonali commerciali, che vengono utilizzati nei laboratori per etichettare i bersagli cellulari più piccoli e specifici per lo studio, ha detto Goodman.
"Sono incredibili, sono strumenti incredibilmente precisi", ha detto Goodman.
Gli anticorpi monoclonali costituiscono anche la base per molti farmaci di successo. Per esempio, il farmaco adalimumab (marca Humira), è un anticorpo monoclonale che tratta l'artrite reumatoide inibendo una proteina infiammatoria nota come citochina. Un altro, chiamato bevacizumab (Avastin), prende di mira una molecola che alimenta la crescita dei vasi sanguigni; bloccando questa molecola, bevacizumab può rallentare la crescita di polmoni, colon, reni e alcuni tumori cerebrali.
E nella pandemia SARS-CoV-2, i medici di tutto il mondo stanno correndo per creare anticorpi monoclonali che si spera neutralizzino il nuovo coronavirus, ha detto Greene. Questi anticorpi vengono filtrati dal plasma delle persone che sono guarite da COVID-19 (chiamato anche siero di convalescenza). La speranza è che isolando gli anticorpi più efficaci e quindi producendoli in massa, i medici possano creare un trattamento che fornisce un'immunità temporanea "passiva" fino a quando il corpo non può recuperare e montare una risposta efficace e più duratura su proprio, disse Greene.
Relazionato: 1 persona su 5 testata a New York ha anticorpi contro il coronavirus
Al contrario, gli anticorpi policlonali derivano da più cellule B. Gli anticorpi policlonali sono una libreria di anticorpi che si legano a parti leggermente diverse dell'antigene o bersaglio. Gli anticorpi policlonali sono tipicamente prodotti iniettando un animale con l'antigene, stimolando una risposta immunitaria e quindi estraendo il plasma degli animali per produrre anticorpi in massa, secondo uno studio del 2005 nella rivista Institute for Laboratory Animal Research (ILAR).
A differenza degli anticorpi monoclonali, che possono richiedere fino a 6 mesi per essere prodotti, gli anticorpi policlonali possono essere prodotti in 4-8 settimane e richiedono meno competenze tecniche. Inoltre, per alcuni tipi di test in cui si sta tentando di rilevare l'antigene, gli anticorpi policlonali potrebbero avere maggiori possibilità di legarsi all'antigene bersaglio, rendendoli potenzialmente più sensibili. Lo svantaggio degli anticorpi policlonali è che, poiché ogni singolo animale potrebbe produrre una serie diversa di anticorpi, rendere gli anticorpi policlonali coerenti da lotto a lotto può essere più difficile, e non è così facile avere una grande scorta, secondo uno studio del 2005 sulla rivista Biotechniques.
Come funzionano i test anticorpali?
I test anticorpali rilevano se il corpo ha prodotto quantità rilevabili di anticorpi contro una determinata molecola e possono quindi rivelare se qualcuno è stato infettato da un virus o da un batterio specifico in passato. Di solito, questi test stanno rilevando IgM o IgG, precedentemente segnalati.
Ad esempio, i test degli anticorpi SARS-CoV-2 rilevano in genere una parte o tutta la proteina spike del coronavirus e possono rivelare se qualcuno ha avuto COVID-19 in passato. Poiché il corpo impiega tempo per aumentare la produzione di anticorpi, le persone di solito risultano positive solo circa due settimane dopo essere state esposte per la prima volta all'agente patogeno, riportato in precedenza.
Relazionato: I test anticorpali possono dire se sei immune a COVID-19?
Esistono due tipi comuni di test anticorpali: test a flusso laterale e test ELISA (test immunoassorbente legato all'enzima). Entrambi prevedono il fissaggio di un antigene su una superficie e quindi la rilevazione se un anticorpo si lega a quell'antigene. Di solito, una reazione chimica, come la fluorescenza o un cambiamento di colore, viene attivata quando l'anticorpo si lega all'antigene. I test a flusso laterale sono simili ai test di gravidanza pipì su stick; invece della pipì, per i test degli anticorpi, il sangue o il siero vengono lavati sulla superficie piana, che di solito è carta. I test ELISA funzionano in base a un principio simile, solo i test sono condotti in micropiastre e richiedono un tecnico di laboratorio, ei risultati potrebbero non essere letti immediatamente, Charlotte Sværke Jørgensen, che studia la sierologia di diagnosi speciale di virus e microbiologia presso lo Statens Serum Institut di Copenaghen, detto in precedenza in una e-mail.
Un buon test anticorpale è quello che produce pochi falsi positivi e pochi falsi negativi, precedentemente segnalati. Per garantire che ciò accada, gli scienziati devono "calibrare" il loro test, ad esempio, assicurandosi che i campioni noti per non avere l'antigene non producano falsamente un test positivo. Ad esempio, con SARs-CoV-2, ciò significherebbe testare campioni di sangue prima dell'inizio della pandemia e assicurarsi che nessun campione risulti positivo. Devono anche prelevare campioni che contengono sicuramente l'anticorpo e assicurarsi che il test degli anticorpi faccia un buon lavoro nel rilevare quei positivi.
Risorse addizionali:
- Guarda un video su come funzionano gli anticorpi, prodotto dal Vaccine Makers Project.
- Maggiori informazioni sui test anticorpali dei Centers for Disease Control and Prevention.
- Leggi cosa ha da dire il direttore del National Institutes of Health, il dottor Francis Collins, sugli anticorpi SARS-CoV-2, come pubblicato sul blog del direttore del NIH il 30 giugno 2020.















