
Thomas Dalton
0
5080
755
Gli scienziati potrebbero finalmente capire la misteriosa transizione dietro un esperimento di chimica secolare. I dettagli di questa trasformazione, in cui l'aggiunta di elettroni a una soluzione di ammoniaca blu brillante la trasforma in un brillante bronzo metallico, sono da tempo sfuggiti agli scienziati..
Il nuovo studio rivela i dettagli sottili di questo cambiamento e mostra che questa trasformazione è graduale, piuttosto che improvvisa. "Quello che abbiamo fatto con successo è che abbiamo praticamente capito come si comportano queste soluzioni a una vasta gamma di concentrazioni utilizzando una tecnica a microjet", ha detto il coautore dello studio Ryan McMullen, dottorando in chimica presso l'Università della California meridionale . Questa tecnica, che prevede di sparare flussi sottili di capelli della soluzione attraverso un vuoto, non è stata utilizzata prima sul liquido brillante.
E la scoperta potrebbe aprire nuovi tipi di reazioni nella chimica organica in futuro, ha detto McMullen .
Relazionato: 8 elementi chimici di cui non hai mai sentito parlare
Cos'è un metallo?
I metalli sono un gruppo eterogeneo. Alcuni, come il litio, sono abbastanza leggeri da galleggiare, mentre altri, come il piombo o l'osmio, sono estremamente densi. Alcuni richiedono temperature incredibilmente elevate per sciogliersi, mentre altri si sciolgono facilmente (il mercurio, ad esempio, si scioglie a meno 38,3 gradi Celsius o meno 37,9 gradi Fahrenheit). In definitiva, ciò che i metalli hanno in comune è la loro capacità di condurre l'elettricità allo zero assoluto, il punto in cui il movimento molecolare dal calore si ferma essenzialmente.
Ma come si trasformano alcuni non metalli in metalli? In un nuovo studio, i ricercatori hanno risposto a questa domanda aggiungendo metalli all'ammoniaca liquida.
In primo luogo, i ricercatori hanno condensato l'ammoniaca, che è un gas a temperatura ambiente, in un liquido raffreddandolo a 27,4 F negativi (meno 33 C). Hanno quindi aggiunto sodio, litio o potassio, che sono tutti metalli alcalini. (È piuttosto famoso, questi metalli reagiscono in modo esplosivo quando vengono immersi nell'acqua.) Gli esperimenti sono stati condotti in collaborazione con scienziati dell'Accademia ceca delle scienze e dell'Istituto Fritz-Haber della Max Planck Society di Berlino, nonché con ricercatori in Giappone e Francia.
Relazionato: Le 10 migliori esplosioni di sempre
Il risultato era una reazione attesa: l'ammoniaca liquida estraeva elettroni dal metallo. Quegli elettroni sono poi rimasti intrappolati tra le molecole di ammoniaca, creando i cosiddetti elettroni solvatati che i ricercatori speravano di studiare. A basse concentrazioni, il risultato era un liquido blu, non metallico. Tuttavia, quando gli elettroni solvatati o intrappolati si accumulavano, la soluzione è passata al bronzo lucido.
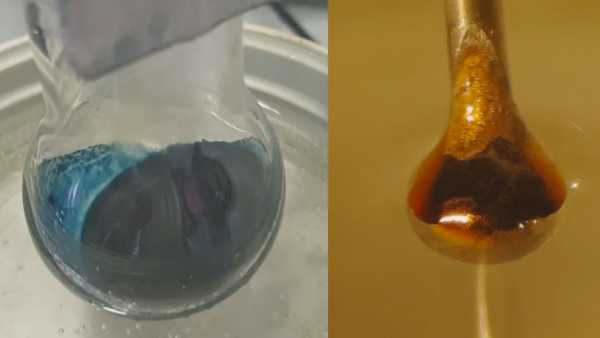
La sfida successiva era studiare come si comportavano gli elettroni solvatati a diverse concentrazioni. Ciò ha comportato la ripresa di un microgetto della soluzione - circa la larghezza di un capello umano - attraverso un raggio di raggi X di sincrotrone, che sono raggi X ad alta energia. I raggi X hanno eccitato gli elettroni solvatati, facendoli saltare fuori dalla loro gabbia liquida di molecole di ammoniaca. I ricercatori hanno quindi potuto misurare quanta energia ci voleva per rilasciare gli elettroni solvatati.
I ricercatori hanno scoperto che maggiore è la concentrazione di elettroni solvatati, più il modello di rilascio di energia corrispondeva a ciò che si vede in un metallo. Ecco cosa significa: se si rappresenta graficamente la quantità di energia richiesta per liberare gli elettroni dalla loro gabbia di ammoniaca liquida, i metalli in genere hanno quello che viene chiamato un "bordo di Fermi", una transizione molto brusca, ha detto McMullen. A concentrazioni inferiori di elettroni solvatati, questo grafico di rilascio di energia sembra più una collina arrotondata. Solo a concentrazioni di elettroni più elevate è emerso questo bordo di Fermi. Il bordo riflette quanta energia hanno gli elettroni a una data temperatura, ha aggiunto McMullen.
"Quando aumenti la concentrazione nella gamma metallica, allora vedi, questo meraviglioso modello emerge che è molto, molto caratteristico di un metallo", ha detto McMullen.
I risultati sono stati interessanti perché hanno mostrato che il liquido simile al metallo creato dalla combinazione di metalli alcalini e ammoniaca è in realtà un metallo a livello fisico fondamentale, ha detto..
"È un vero metallo, non è qualcosa che assomiglia a uno", ha detto McMullen.
Gli elettroni solvatati a concentrazione più bassa vengono utilizzati in un tipo di reazione chiamata reazione di betulla, che aggiunge elettroni a strutture molecolari chiamate anelli aromatici. Questo tipo di reazione è stato utilizzato nella produzione delle prime pillole contraccettive orali negli anni '50, ha detto McMullen. Comprendendo come gli elettroni solvatati funzionano ad alte concentrazioni, i ricercatori possono potenzialmente trovare nuovi tipi di reazioni chimiche, ha detto. Ad esempio, potrebbero eccitare gli elettroni solvatati con fasci di luce per indurli a comportarsi in modi nuovi.
"Se solletichi un po 'gli elettroni in modo che siano più energeticamente eccitati, puoi iniziare a guardare alcune reazioni folli che altrimenti non sarebbero mai accadute", ha detto McMullen.
I ricercatori hanno riportato i loro risultati il 5 giugno sulla rivista Science.
Vedi tutti i commenti (2)














