
Phillip Hopkins
0
2005
422
Nota del redattore: questa storia è stata aggiornata il 17 agosto per includere:
- Dati di uno studio che ha testato il vaccino di Moderna su scimmie macaco rhesus
- Nuovi dati di fase 1 / fase 2 che testano il vaccino candidato di Sinopharm
- Dati per il vaccino candidato di Johnson & Johnson
Utilizzando materiali da virus del raffreddore indeboliti a frammenti di codice genetico, gli scienziati di tutto il mondo stanno creando dozzine di candidati vaccini unici per combattere il nuovo coronavirus e lo stanno facendo a velocità senza precedenti.
Oltre sette mesi dopo che l'Organizzazione mondiale della sanità (OMS) ha allertato per la prima volta il mondo su un misterioso gruppo di casi di polmonite a Wuhan, in Cina, sono in fase di sviluppo 167 vaccini candidati per prevenire il coronavirus che ha causato la malattia (chiamato COVID-19), secondo OMS. La maggior parte dei vaccini candidati sono in fasi precliniche, il che significa che sono ancora in fase di sperimentazione su animali o in laboratorio, ma una manciata di loro ha raggiunto prove umane.
Tali studi clinici sono suddivisi in tre o quattro fasi, con fasi precedenti (fase 1 / fase 2) che esaminano la sicurezza, il dosaggio e i possibili effetti collaterali e l'efficacia (quanto bene funziona nel combattere il patogeno) del vaccino candidato in un piccolo gruppo di persone, secondo la Food and Drug Administration (FDA). La chiave per ottenere l'approvazione di un vaccino candidato, tuttavia, è mostrare risultati promettenti nella sperimentazione di fase 3 più avanzata.
Relazionato: Aggiornamenti in tempo reale sul coronavirus
Nelle sperimentazioni di fase 3, i ricercatori testano l'efficacia del vaccino, monitorando le reazioni avverse in centinaia o migliaia di volontari. La FDA approva quindi il vaccino se gli studi dimostrano che è sicuro ed efficace, ei benefici del vaccino superano i suoi rischi, secondo i Centers for Disease Control and Prevention (CDC). Secondo l'OMS, cinque candidati al vaccino contro il coronavirus hanno iniziato a reclutare o sono in fase di sperimentazione di fase 3. Ecco i più promettenti di quei candidati:
Università di Oxford / AstraZeneca

Il vaccino attualmente chiamato ChAdOx1 nCoV-19, popolarmente noto come vaccino di Oxford, è stato sviluppato dall'università britannica in collaborazione con l'azienda farmaceutica AstraZeneca. Il vaccino è costituito da una versione indebolita di un comune virus del raffreddore, chiamato adenovirus, che infetta gli scimpanzé. I ricercatori hanno alterato geneticamente il virus in modo che non potesse replicarsi negli esseri umani e hanno aggiunto geni per codificare le cosiddette proteine spike che il coronavirus utilizza per infettare le cellule umane. In teoria, il vaccino insegnerà al corpo a riconoscere questi picchi, in modo che quando una persona è esposta, il sistema immunitario può distruggerla, secondo un precedente rapporto.
I ricercatori hanno precedentemente testato questo vaccino su scimmie macaco rhesus e hanno scoperto che non ha impedito alle scimmie di essere infettate se esposte deliberatamente al coronavirus, ma ha impedito loro di sviluppare polmonite, suggerendo che fosse parzialmente protettivo, secondo uno studio pubblicato il 13 maggio. al database di prestampa BioRxiv.
Ad aprile, i ricercatori hanno iniziato a testare il vaccino su persone e hanno pubblicato i primi risultati dei loro studi di fase 1 e di fase 2 ancora in corso il 20 luglio sulla rivista The Lancet. Il vaccino non ha causato effetti avversi gravi nei partecipanti, ma ha provocato alcuni lievi effetti collaterali, come dolori muscolari e brividi. Il vaccino ha stimolato il sistema immunitario a produrre cellule T specifiche per SARS-CoV-2 - un gruppo di globuli bianchi importanti nella lotta contro i patogeni - e anticorpi neutralizzanti, o molecole che possono attaccarsi al virus e impedirgli di infettare le cellule , secondo il rapporto.
Le sperimentazioni di fase 3 sono già iniziate in Brasile e arruoleranno fino a 5.000 volontari. Si prevede che un altro studio di fase 3 arruolerà altre 10.500 persone nel Regno Unito e 30.000 negli Stati Uniti, secondo la pagina web della sperimentazione sul vaccino di Oxford e il New York Times. Il team di Oxford ha anche espresso interesse a condurre studi di sfida sugli esseri umani, il che significa che avrebbero deliberatamente infettato i volontari a basso rischio con il virus, insieme alle prove di fase 3 o dopo che sono state completate, secondo The Guardian.
Il Dipartimento della salute e dei servizi umani (HHS) degli Stati Uniti ha annunciato che darà fino a $ 1,2 miliardi ad AstraZeneca per accelerare il processo di sviluppo del vaccino e per aiutare l'azienda a produrre almeno 300 milioni di dosi del vaccino - se si dimostrerà sicuro ed efficace - già nell'ottobre 2020, secondo una dichiarazione. Questo fa parte dell'operazione Warp Speed dell'amministrazione Trump, un'iniziativa che mira a fornire 300 milioni di dosi di un vaccino sicuro ed efficace entro gennaio 2021, secondo HHS..
Sinovac Biotech
Un altro vaccino candidato, chiamato (PiCoVacc) e sviluppato dalla Sinovac Biotech con sede a Pechino, protegge le scimmie macaco rhesus dall'infezione con il nuovo coronavirus, secondo uno studio pubblicato il 3 luglio sulla rivista Science. L'azienda, avendo già dimostrato che il vaccino è sicuro ed efficace nelle prime sperimentazioni cliniche, sta reclutando per uno studio clinico di fase 3 con 8.870 partecipanti in Brasile, secondo clinicaltrials.gov.
Questo vaccino è costituito da una versione inattivata del virus SARS-CoV-2. I vaccini inattivati sono la versione morta dell'agente patogeno che causa la malattia (al contrario dei virus indeboliti che sono vaccini vivi), secondo il Dipartimento della salute e dei servizi umani (HHS) degli Stati Uniti. I virus inattivati come il vaccino contro l'influenza o il vaccino contro l'epatite A, in genere non sono protettivi come i vaccini vivi e potrebbero richiedere colpi di richiamo nel tempo, secondo l'HHS. Al contrario, il vaccino di Oxford è una forma indebolita di un vaccino vivo, che può creare risposte immunitarie di lunga durata ma tende ad essere più rischioso per le persone con un sistema immunitario indebolito o altri problemi di salute, secondo l'HHS..
Sinovac ha iniziato le sperimentazioni di fase 1 / fase 2 (coinvolgendo 743 adulti sani) ad aprile nella provincia cinese di Jiangsu. Hanno dato ai partecipanti due dosi del vaccino, a due settimane di distanza, e hanno riferito che il vaccino non ha causato eventi avversi gravi, secondo una dichiarazione. Gli autori dello studio hanno anche affermato che più del 90% dei partecipanti aveva sviluppato anticorpi neutralizzanti il vaccino due settimane dopo aver ricevuto la seconda dose. Tuttavia, i loro risultati sono stati riportati solo in un comunicato stampa e non sono stati ancora pubblicati in una rivista peer-reviewed. La società sta ora conducendo una sperimentazione di fase 2 su adulti anziani e successivamente ne condurrà una su bambini e adolescenti, secondo un'altra dichiarazione. Sinovac in precedenza utilizzava la stessa tecnologia per creare vaccini approvati per l'epatite A, l'epatite B e l'influenza suina, l'influenza aviaria e il virus che causa l'afta epizootica della mano, secondo STAT News.
Moderna / Istituto nazionale di allergie e malattie infettive

Questo vaccino candidato (mRNA-1273), sviluppato dalla società biotecnologica americana Moderna e dal National Institute of Allergy and Infectious Diseases (NIAID), è stato il primo ad essere testato sugli esseri umani negli Stati Uniti, secondo un precedente rapporto..
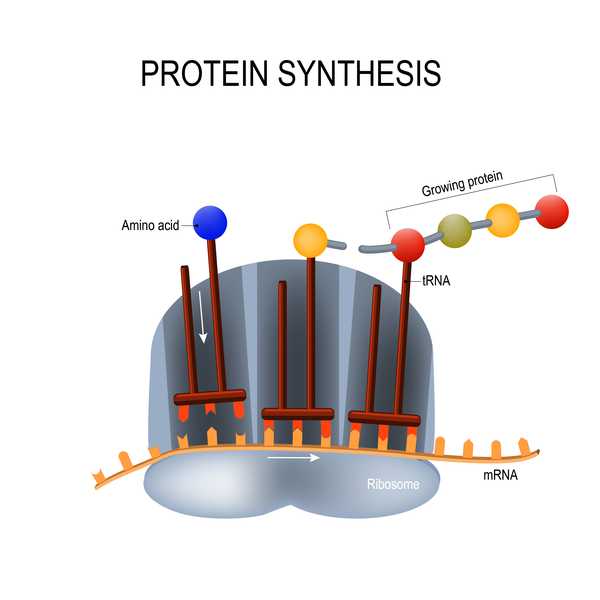
Il vaccino di Moderna si basa su una tecnologia che non è stata utilizzata fino ad oggi in nessun vaccino approvato: un pezzo di materiale genetico chiamato RNA messaggero (mRNA). I vaccini tradizionali sono costituiti da virus indeboliti o inattivi, o proteine di quei virus, per innescare una risposta immunitaria; I vaccini a mRNA, d'altra parte, sono costituiti da materiale genetico che insegna alle cellule a costruire da sole queste proteine virali (in questo caso, la proteina spike del coronavirus). Sia i vaccini tradizionali che quelli a mRNA innescano una risposta immunitaria nel corpo in modo tale che se una persona è naturalmente esposta al virus, il corpo può riconoscerlo e combatterlo rapidamente.
Questi vaccini a mRNA hanno diversi vantaggi, tra cui essere più veloci e più facili da produrre rispetto ai vaccini tradizionali, che possono richiedere tempo per svilupparsi perché gli scienziati devono coltivare e inattivare interi patogeni o le loro proteine, secondo National Geographic. I vaccini a mRNA potrebbero anche essere più durevoli contro i patogeni che tendono a mutare, come i coronavirus e i virus influenzali. Tuttavia, i vaccini a mRNA possono causare reazioni avverse nel corpo; questi tipi di vaccini hanno anche problemi di stabilità, si rompono abbastanza rapidamente, il che potrebbe limitare la forza dell'immunità, secondo National Geographic.
I vaccini a mRNA hanno dimostrato di essere "un'alternativa promettente" ai vaccini tradizionali, ma "la loro applicazione è stata fino a poco tempo limitata dall'instabilità e dall'inefficienza" della somministrazione nell'organismo, ha riferito un gruppo di ricercatori in una recensione del 2018 pubblicata sulla rivista Nature Reviews Scoperta di nuovi farmaci. "I recenti progressi tecnologici hanno ora ampiamente superato questi problemi e più piattaforme di vaccini a mRNA contro malattie infettive e diversi tipi di cancro hanno dimostrato risultati incoraggianti sia nei modelli animali che nell'uomo".
Il 14 luglio Moderna ha pubblicato i primi promettenti risultati di uno studio di fase 1 composto da 45 partecipanti al New England Journal of Medicine. I partecipanti sono stati divisi in tre gruppi e hanno ricevuto una dose di vaccino bassa, media o alta. Dopo aver ricevuto due dosi del vaccino, tutti i partecipanti hanno sviluppato anticorpi neutralizzanti a livelli superiori alla media di quelli trovati nei pazienti COVID-19 recuperati, riportati.
Il vaccino è apparso sicuro e generalmente ben tollerato, ma più della metà dei partecipanti ha avuto alcuni effetti collaterali (simili agli effetti collaterali che possono verificarsi dal vaccino antinfluenzale annuale) tra cui affaticamento, brividi, mal di testa, dolori muscolari e dolore al sito di iniezione . Alcuni partecipanti nei gruppi a dose media e alta hanno manifestato febbre dopo la seconda iniezione. Una persona che ha ricevuto la dose più alta ha sperimentato febbre "grave", nausea, vertigini e un episodio di svenimento, secondo il rapporto. Ma questo partecipante si è sentito meglio dopo un giorno e mezzo. Dosi così elevate non verranno somministrate ai partecipanti alle prossime sperimentazioni.
La sperimentazione di fase 2 di Moderna è ancora in corso e il 27 luglio la società ha avviato la sperimentazione di fase 3 negli Stati Uniti, secondo un rapporto. Si prevede che la sperimentazione arruolerà circa 30.000 partecipanti entro la fine dell'estate e i primi risultati dello studio potrebbero essere disponibili entro novembre, secondo il rapporto.
Ad aprile, l'HHS, nell'ambito dell'operazione Warp Speed, si è impegnato a spendere fino a 483 milioni di dollari per lo sviluppo accelerato del vaccino di Moderna.
Il 28 luglio, gli scienziati hanno pubblicato un nuovo sul New England Journal of Medicine che descrive in dettaglio come il vaccino di Moderna ha indotto una forte risposta immunitaria nelle scimmie macaco rhesus. Dopo aver ricevuto 10 o 100 μg dose del vaccino e poi una seconda dose due settimane dopo (ad alcune non è stato somministrato un vaccino e sono servite come punto di confronto), le scimmie sono state "sfidate" o esposte al coronavirus alla settimana 8. I ricercatori hanno scoperto che le scimmie hanno sviluppato una forte risposta immunitaria al virus, poiché il loro sistema immunitario ha prodotto sia anticorpi neutralizzanti che cellule T. Due giorni dopo che le scimmie sono state esposte al coronavirus, i ricercatori non sono stati in grado di rilevare alcuna replicazione virale nel naso o nei polmoni, suggerendo che il vaccino proteggesse dalle infezioni precoci. (Questo è in contrasto con lo studio dell'Università di Oxford condotto sulle scimmie, che sembrava impedire alle scimmie di sviluppare la polmonite, ma non ha impedito loro di essere infettate dal nuovo coronavirus.)
CanSino Biologics / Beijing Institute of Biotechnology
CanSino Biologics, in collaborazione con il Beijing Institute of Biotechnology, ha sviluppato un vaccino candidato utilizzando un adenovirus indebolito. A differenza del vaccino di Oxford, che si basa su un adenovirus che infetta gli scimpanzé, CanSino Biologics utilizza un adenovirus che infetta gli esseri umani.
Insieme a Moderna, questo gruppo ha anche pubblicato i risultati del loro studio di fase 2 il 20 luglio sulla rivista The Lancet. Lo studio, che è stato condotto a Wuhan (dove sono emersi i primi casi di coronavirus), ha coinvolto 508 partecipanti che sono stati assegnati in modo casuale a ricevere una delle due diverse dosi del vaccino o un placebo.
Anche questo studio non ha rilevato eventi avversi gravi, sebbene alcuni abbiano riportato reazioni lievi o moderate tra cui febbre, affaticamento e dolore al sito di iniezione. Secondo lo studio, circa il 90% dei partecipanti ha sviluppato risposte delle cellule T e circa l'85% ha sviluppato anticorpi neutralizzanti.
"I risultati di entrambi gli studi sono di buon auspicio per gli studi di fase 3, in cui i vaccini devono essere testati su popolazioni di partecipanti molto più ampie per valutarne l'efficacia e la sicurezza", Naor Bar-Zeev e William J Moss, entrambi parte del John Hopkins 'International Vaccine Access Center, ha scritto in un commento di accompagnamento su The Lancet riferendosi a questo studio e allo studio sul vaccino di Oxford pubblicato nella stessa rivista. "Nel complesso, i risultati di entrambi gli studi sono sostanzialmente simili e promettenti".
Stanno ora cercando di condurre una sperimentazione di fase 3 al di fuori della Cina, secondo Reuters.
Sinopharm
Il vaccino candidato del China National Pharmaceutical Group (Sinopharm) di proprietà statale è una forma inattivata di SARS-CoV-2. Il 13 agosto, la società ha pubblicato i dati dei suoi studi clinici di fase 1 e fase 2 sulla rivista JAMA. Nello studio di fase 1, 96 adulti sani sono stati assegnati in modo casuale a ricevere una dose bassa, media o alta del vaccino o a ricevere idrossido di alluminio come placebo. Sono state somministrate la seconda e la terza dose del vaccino (o del placebo) rispettivamente dopo 28 giorni e 56 giorni. I ricercatori hanno scoperto che il vaccino ha attivato i loro corpi per produrre anticorpi neutralizzanti. Nei partecipanti che hanno ricevuto il placebo, il 12,5% ha avuto reazioni avverse. In coloro che hanno ricevuto vaccini a basso, medio e alto dosaggio, il 20,8%, il 16,7% e il 25% hanno avuto reazioni avverse lievi, rispettivamente, secondo lo studio. Nello studio di fase 2, a 224 adulti è stata somministrata una dose media o un placebo e quindi una seconda iniezione 14 giorni o 21 giorni dopo la prima. Ancora una volta, i partecipanti hanno sviluppato anticorpi neutralizzanti e hanno riportato alcune lievi reazioni avverse. La reazione avversa più comune è stata dolore al sito di iniezione e quindi febbre lieve. "Non sono state osservate reazioni avverse gravi", hanno scritto gli autori.
La società ha già iniziato la sua fase 3 di prova ad Abu Dhabi, che recluterà fino a 15.000 persone, secondo Reuters. I partecipanti riceveranno uno dei due ceppi vaccinali o un placebo, secondo Reuters.
Pfizer / BioNTech / Fosun Pharmaceutical
Pfizer e l'azienda biotecnologica tedesca BioNTech stanno, come Moderna, sviluppando un vaccino che utilizza l'RNA messaggero per spingere il sistema immunitario a riconoscere il coronavirus.
Il vaccino non ha causato eventi avversi gravi e potrebbe stimolare una risposta immunitaria, secondo i dati iniziali di fase 1 / fase 2 rilasciati al database di preprint medRxiv il 1 ° luglio e che non sono ancora stati sottoposti a revisione paritaria. Lo studio ha coinvolto 45 pazienti a cui è stata somministrata una delle tre dosi del vaccino candidato o di un placebo. Nessuno dei pazienti ha avuto effetti collaterali gravi, ma alcuni hanno sviluppato effetti collaterali come febbre (75% nel gruppo con la dose più alta), affaticamento, mal di testa, brividi, dolori muscolari e dolori articolari.
I ricercatori hanno scoperto che il vaccino ha spinto il sistema immunitario a produrre anticorpi neutralizzanti a livelli da 1,8 a 2,8 volte superiori a quelli trovati nei pazienti guariti, secondo lo studio. Successivamente, Pfizer ha annunciato nuovi risultati (in un comunicato stampa, quindi i risultati non sono sottoposti a revisione paritaria) secondo cui il vaccino ha anche indotto la produzione di cellule T specifiche per il nuovo coronavirus.
Questa settimana, l'amministrazione Trump ha annunciato un contratto da 1,95 miliardi di dollari con Pfizer e BioNTech per produrre almeno 100 milioni di dosi del loro vaccino entro la fine dell'anno se si dimostrerà sicuro ed efficace (con fino a 500 milioni di dosi in più se necessario) . Gli americani riceverebbero il vaccino gratuitamente, secondo il New York Times. In precedenza, le due società hanno annunciato un accordo con il Regno Unito per 30 milioni di dosi del vaccino candidato se funziona e viene approvato, secondo una nota. Secondo il Times, Pfizer sta pianificando una sperimentazione di fase 3 su larga scala che inizi questo mese e una revisione normativa già a ottobre.
Società farmaceutiche Janssen di Johnson & Johnson
Anche il vaccino sperimentale COVID-19 Janssen di Johnson & Johnson, chiamato Ad26, è stato sviluppato da un adenovirus indebolito. Questo tipo di vaccino è chiamato vaccino a base di vettore perché utilizza un virus indebolito (un vettore) per fornire informazioni sull'agente patogeno al corpo per stimolare la risposta immunitaria. In questo caso, l'adenovirus indebolito esprime la proteina "spike" SARS-CoV-2. Janssen sta usando la stessa tecnologia usata per sviluppare il suo vaccino contro l'Ebola.
I ricercatori hanno riferito il 30 luglio sulla rivista Nature che un singolo colpo del vaccino Ad26 ha protetto i macachi rhesus dall'infezione con SARS-CoV-2. In questo studio, gli scienziati hanno testato sette tipi leggermente diversi di prototipi di vaccino Ad26 e hanno identificato quello che ha prodotto il maggior numero di anticorpi neutralizzanti. Dopo aver ricevuto la variante scelta, le scimmie sono state quindi esposte al coronavirus. Sei scimmie su sette a cui è stato somministrato questo prototipo di vaccino, chiamato Ad26.COV2.S, e quindi esposte al coronavirus, non hanno mostrato alcun virus rilevabile nel tratto respiratorio inferiore e una ha mostrato livelli molto bassi nel naso, secondo la dichiarazione..
La sperimentazione clinica di fase 1 / 2a di Johnson & Johnson su Ad26.COV2.S è attualmente in corso negli Stati Uniti e in Belgio. Lo studio prevede l'arruolamento di 1.045 partecipanti sani di età compresa tra 18 e 55 anni e di età superiore ai 65 anni. Testeranno la sicurezza del vaccino, eventuali effetti collaterali e la risposta immunitaria che i partecipanti svilupperanno, secondo le ultime notizie di Johnson & Johnson . Testeranno anche vari programmi e dosi di vaccinazione. Secondo Johnson & Johnson, ci sono ulteriori piani per un altro studio di fase 1 sul candidato vaccino in Giappone e uno studio di fase 2 in Paesi Bassi, Spagna e Germania. Se il vaccino si dimostrerà sicuro ed efficace in questi studi, i ricercatori inizieranno gli studi di fase 3 a settembre con una stima di 60.000 partecipanti in tutto il mondo.
Johnson & Johnson ha recentemente annunciato un accordo da 1 miliardo di dollari con il governo degli Stati Uniti per fornire 100 milioni di dosi del vaccino negli Stati Uniti se riceve l'approvazione o l'autorizzazione per l'uso di emergenza dalla Food and Drug Administration degli Stati Uniti, secondo una dichiarazione.
Vedi tutti i commenti (2)














